- Haben Sie noch Fragen? Kontaktieren Sie uns
- info@dr-rath-foundation.org

Hamburger Gericht stellt Verfahren gegen Dr. Rath ein
März 20, 2016
Einlassung von Herrn Dr. Matthias Rath im Rahmen der Gerichtsverhandlung am 21. September 2006 beim Amtsgericht Hamburg
März 21, 2016Die Wirkung von Nährstoff-Synergie auf menschliche Osteosarkom-Zellen U-2 OS
M.Waheed Roomi, Vadim Ivanov, Matthias Rath und Aleksandra Niedzwiecki
Corresponding Author: Alexandra Niedzwiecki, Ph.D.
1260 Memorex Drive
Santa Clara, CA, 94050 USA
Phone: 408-567-5564
Fax: 408-986-9403
Email: a.niedz@drrath.com
Kurzfassung
Einführung:
Die derzeitige Therapie eines primären malignen Tumors der Kochen oder Weichteile, der aus Knochen formenden Mesenchym-Zellen entsteht, weist eine dürftige Prognose auf, besonders aufgrund des erhöhten Risikos, dass sich durch die Chemotherapie andere Karzinome entwickeln. Deshalb sind neue Behandlungsstrategien notwendig, die ohne toxische Nebeneffekte wirksam sind. Die kürzlich in unserem Labor durchgeführte In- vitro-Studie hat gezeigt, dass Nährstoff-Synergie (NS), eine einzigartige Rezeptur, zusammengesetzt aus Lysin, Prolin, Arginin, Ascorbinsäure und EpigallocatechinGallat einen chemopräventiven Effekt auf verschiedene Krebsarten ausübt. NS zeigte potenzielle synergetische Antikrebs-Aktivität durch Hemmung von Matrix Metalloproteinasen, Schlüsselenzymen gegen Invasion und Metastasen.
Zielsetzung:
Wir untersuchten die Wirkung von Nährstoff-Synergie auf menschliche Osteosarkomzellen U-2 Os durch Messung der Zytotoxizität, Einstellung der Matrix Metalloproteinasen (MMPs): MMP-2 und MMP-9 und das invasive Potenzial.
Methoden und Stoffe:
Menschliche Osteosarkomzellen U-2 Os wurden im McCloy-Medium kultiviert, das mit 10 % fetalem Rinderserum beaufschlagt war, und mit antibiotischen 24-Napf-Kulturplatten. Bei der Konfluenz wurden die Zellen zu 0, 10, 50, 100, 500 und 1000 m g/ml Nährstoff-Synergie angesetzt, jede Dosis in dreifacher Ausfertigung. Die Zytotoxizität wurde beurteilt nach der Anzahl der Zellen, gemessen durch den MTT-Test nach 24 Stunden, MMP-Expression durch gelatinase Zymographie im Kontrollmedium und Invasion durch Matrigel.
Ergebnisse:
Nährstoff-Synergie war nicht toxisch bei 10 m g/ml und der vorliegenden Dosisreaktion der Toxizität von maximal 60% über der Kontrollmarke von 1000 m g/ml. Die Zymographie zeigte eine von der Dosis abhängige Hemmung des MMP-2 und MMP-9 Ausstoßes durch Nährstoff-Synergie mit faktisch totaler Hemmung bei einer Konzentration von 500 m g/ml. Die Invasion von Osteosarkomzellen durch Matrigel war beträchtlich reduziert bei 50 m g/ml (74%) und vollständig gehemmt bei einer Konzentration von 100 m g/ml.
Folgerung:
Unsere Ergebnisse weisen darauf hin, dass Nährstoff-Synergie ein ausgezeichneter Kandidat für den therapeutischen Gebrauch bei der Behandlung von Osteosarkomen ist wegen der Hemmung der MMP-Expression, der Anglogenese und der Invasion – alles wichtige, viel versprechende Parameter für die Krebsvorsorge.
Einführung
Osteosarkom, ein primärer maligner Tumor der Knochen oder Weichteile, der aus den Knochen formenden Mesenchym-Zellen entsteht, entwickelt sich im allgemeinen im distalen Femur (Oberschenkelknochen), der proximalen (rumpfwärts gelegenen) Tibia (Schienbein), dem proximalen Humerus (Oberarmknochen) und dem distalen Radius (Speiche). Das klassische Osteosarkom zeigt aggressives schnelles Wachstum mit hohem Risiko für lokale Neben-Metastasen und frühen Lungen-Metastasen. Es ist der häufigste Knochenkrebs und der sechsthäufigste Kinderkrebs, der sich typischerweise bei Halbwüchsigen entwickelt, die einen Wachstumsschub durchmachen. Er ist häufiger bei Jungen als bei Mädchen. Die meisten Osteosarkome entstehen aus nicht-ererbten Fehlern in der DNA der wachsenden Knochenzellen. Da diese Fehler zufällig und unvorhersehbar während des Knochenwachstums vorkommen, ist es gegenwärtig nicht möglich, diesen Krebstyp wirksam zu verhindern (1).
Die gegenwärtigen Therapien von Osteosarkomen bestehen aus Chirurgie (Amputation oder Gliedmaßenrettungschirurgie) und Chemotherapie. Diese Therapien sind mit dürftiger Prognose verbunden, besonders aufgrund der hochinvasiven Natur dieser Krebsart und des erhöhten Risikos von Metastasen und der Entwicklung von anderen Krebsen durch die Chemotherapie. Von 31 Versuchspatienten, die mit lokalisiertem Osteosarkom diagnostiziert wurden (2), und die mit konventioneller Chemotherapie behandelt wurden (hochdosiertes Methotrexat und Leucovarin Rettung bei 3 Patienten und intraarterielles Cisplatin bei 28 Patienten) am Anderson Krebs-Zentrum erfuhren nur 3 Patienten keinen lokalen Rückfall oder Lungenmetastasen während der nachfolgenden Zeit von 225+ Monaten. Zu den Nebeneffekten der Chemotherapie zählen auch Anämie, unnormale Blutung, erhöhtes Infektionsrisiko wegen der Zerstörung von Knochenmark, Leber und Nierenschädigung, menstruale Unregelmäßigkeiten, Blasenentzündung und Blut im Urin, Hautosteosarkom und Osteosarkom, das in Lunge, Gehirn oder andere Knochen metastasiert (1).
Einer der Schlüsselmechanismen, wie Krebszellen sich verbreiten und im Körper metastasieren, schließt auch die enzymatische Zerstörung des Bindegewebes mit ein. Therapeutische Versuche, diesen Prozess mit spezifischen Medikamenten einzuschränken, waren nicht erfolgreich, und derzeitig sind keine anderen Mittel verfügbar, um die Krebsmetastasen einzuschränken. Seit Jahrzehnten besteht die Standardtherapie für Osteosarkom aus Chirurgie und Chemotherapie, die auf die Zerstörung der Krebszellen gerichtet sind, jedoch nicht die Metastasen erfassen. Die Bestrahlung und Chemotherapie zeigen sich nicht nur als ineffektiv eine Heilung zu erreichen, greifen jedoch wahllos alle Zellen an, verursachen Zellschäden, zerstören Bindegewebe und ermöglichen damit die Krebsmetastasen. Offensichtlich besteht die Notwendigkeit für ein sicheres und effektives natürliches Verfahren, das den Prozess von Krebsmetastasen einschränken kann.
Alle Typen von Krebszellen bilden Tumore durch die Schwächung der extrazellulären Matrix (ECM) mit Hilfe verschiedener Matrix Metalloproteinasen (MMPs). Die Aktivität dieser Enzyme geht einher mit der Aggressivität des Tumorwachstums und der Zudringlichkeit des Krebses. 1992 stellten Rath und Pauling (3) fest, dass Nährstoffe wie Lysine und Askorbinsäure als natürliche Hemmer der ECM-Protoanalyse wirken könnten, und dass sie das Potenzial besitzen, das Wachstum und die Expansion von Tumoren zu beeinflussen. Diese Nährstoffe können ihren Anti-Tumor-Effekt durch verschiedene Mechanismen ausüben. Darunter die Hemmung der MMPs und Stärkung des Bindegewebes, das die Krebszellen umgibt (Tumoreinkapselungseffekt). In einer früheren Studie zeigten wir dieses antiproliferative und antiinvasive Potenzial von Lysin, Askorbinsäure, Prolin und Epig a llocatechin-Gallat (ECGC) auf menschlichen Brustkrebs (MDA-MB 231), Kolon-(Dickdarm)-Krebszellen (HCT 115) und Melanomzellarten (A2058) (4). Nährstoff-Synergie unterdrückte auch das Wachstum dieser Tumore ohne widrige Effekte bei nackten Mäusen. In der derzeitigen Studie untersuchten wir das Antitumorpotenzial von Nährstoff-Synergie in vitro an menschlichen Osteosarkomzellarten U-2 OS.
Zielsetzung
Wir untersuchten den Effekt von Nährstoff-Synergie (NS) auf menschliche Osteosarkomzellen U-2 OS durch das Messen von Zytotoxizität und Regulierung der Matrix Metalloproteinasen (MMPs), MMP-2 und MMP9 sowie das invasive Potenzial.
Methoden und Stoffe
Zell-Kulturen
Menschliche Osteosarkomzellen U-2 OS wurden beschafft von ATCC (American Type Culture Collection, Rockville, MD) und gezogen in McCoy-Medium, das angereichert war mit 10% fetalem Rinderserum, Penicillin (100 U/ml) und Streptomycin (100 mg/ml) in 24-Napf-Kulturplatten (Costar, Cambridge, MA). Die Zellen wurden bebrütet mit 1 ml des Mediums bei 37 °C in einem Gewebekultur-Inkubator (Brutapparat) bei gleichbleibend 95 % Luft und 5 % CO 2 . Bei Konfluenz wurden die Zellen mit Nährstoff-Synergie behandelt, im Medium gelöst und bei 0, 10, 100 und 1000 mM getestet, jede Dosis in dreifacher Ausfertigung. Die Platten wurden dann wieder in den Inkubator eingelegt. Die Zytotoxizität der Reagenzien wurde nach der nachfolgenden 24-stündigen Inkubation geprüft.
MTT-Test
Die Lebensfähigkeit/Zytotoxizität wurde beurteilt nach der Zellproliferation durch den MTT-Test sowohl in serumfreien Medien wie auch in Medien, die mit 10% PBS angereichert waren. Die serumfreien Medien der Zellen wurden entnommen und auf MMPs getestet. Die Zellen in den Näpfchen wurden mit einer, mit Phosphat vermengten Saline gewaschen (PBS), und 500 m l von MTT (Sigma #M- 2128) 5 mg/ml in PBS wurde jedem Napf beigegeben. Die Kulturenplatten wurden bei 37 °C zusätzlich 2 Stunden lang bebrütet. Die Medien wurden sorgfältig aspiriert und 1 ml DMSO (Dimethylsulfoxyd) wurde jeder beigesetzt, um die blauen Formazankristalle, die sich gebildet hatten, aufzulösen. Die optische Dichte wurde gemessen bei 590n. Die OD 550 der DMSO-Lösung in jedem Napf wurde mit dem BioSpec 1501, Shimadzu Spektrophotometer direkt betrachtet. Die OD 590 der DMSO-Lösung in jedem Napf wurde als proportional zur Anzahl der Zellen betrachtet. Die OD 590 der Kontrolle (Behandlung ohne Zusatz) wurde als 100 % betrachtet.
Gelatinase Zymographie
Der MMP-Expression im Vorgabemedium wurde durch Gelatinase Zymographie bestimmt. Die Gelatinase Zymographie wurde dargestellt in 10%igem Polyacrylamid Gel (Bio-Rad, Hercules, CA) in Anwesenheit von 0,1%iger Gallerte. Das Kulturenmedium (20 m l) wurde geladen und SDS-PAGE wurde mit einem Tris-Glycin Puffer dargestellt. Nach der Elektrophorese wurden die Gele mit 5%igem Triton X-100 für 30 Minuten gewaschen. Nach dem Waschen wurden die Gele für 24 Stunden bei 37°C bebrütet, in Anwesenheit von 50 mM Tris-HCI, 5 mM CaCl 2, 5 m M ZnCl 2 , PH 7,5 und 30 Minuten lang mit Coomessie Blau R 0,5% gefärbt und wieder abgefärbt. Die Protein-Standards wurden laufend eingehalten und das ungefähre Molekulargewicht wurde bestimmt.
Matrigel-Invasionsstudien
Die Invasionsstudien wurden durch Anwendung von Matrigel-Einlagen (Becton Dickinson) in die 24-Napf-Platten ausgeführt. Osteosarkomzellen, suspendiert in einer mit Nährstoffen beaufschlagten Medium-Lösung, wie im Entwurf des Experiments spezifiziert, wurden in die Einlage der Näpfe eingegeben. So erhielten sowohl das Medium auf der Einlage wie auch in den Näpfen dieselben Zusätze. Die Platten mit den Einlagen wurden dann in einem Kulturen-Inkubator, ausbalanciert mit 95 % Luft und 5 % CO 2, für 24 Stunden bebrütet. Nach der Inkubation wurden die Medien aus den Näpfen herausgenommen. Die Zellen auf der oberen Oberfläche der Einlagen wurden mit Baumwolltupfern sorgsam weggekratzt. Die Zellen, die die Mitragel-Membran durchdrungen hatten und auf die untere Oberfläche des Matrigels gewandert waren, wurden mit Hematoxylin und Eosin gebeizt und unter dem Mikroskop optisch gezählt.
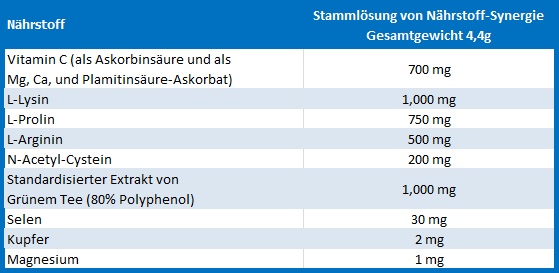
Tabelle 1 – Zusammensetzung der Nährstoff-Synergie
Eine Stammlösung von Nährstoff-Synergie, die gemäß den unten gezeigten Proportionen zusammengesetzt war, wurde in einem Medium gelöst, wie im Entwurf des Experiments angezeigt, um die Zellen zu behandeln.
Statistische Analyse
Die Ergebnisse wurden als Durchschnittswerte angegeben + SE für Gruppen. Die Daten wurden durch einen unabhängigen „T“-Test analysiert.
Ergebnisse
1. Osteosarkome Zytotoxizität / Proliferations-Studie
Nährstoff-Synergie wurde bei 10 m g/ml nicht toxisch und zeigte eine Dosisreaktion der Toxizität mit einer maximalen Toxizität von 60 % über der Kontrolle von 1000 m g/ml, wie in Figur 1 gezeigt. Die Ergebnisse waren statistisch signifikant (P < 0,01)
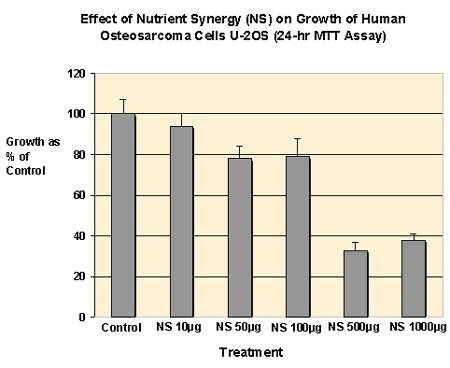
Figur 1 — Wirkung von Nährstoff-Synergie (NS) auf das Wachstum von menschlichen Osteosarkomzellen U-2 OS (24 Stunden MTT-Test)
2. Gelatinase Zymographie-Studie
Wie in Fig. 2 zu sehen ist, zeigte die Zymographie die Expression von MMP-2 und MMP-9 durch menschliche Osteosarkomzellen U-2 OS; Nährstoff-Synergie hemmte die Expression beider MMPs in einer dosisabhängigen Art mit faktisch totaler Hemmung bei der Konzentration von 500 m g/ml.
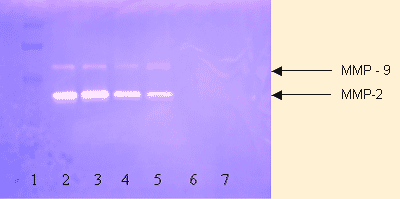
Figur 2 — Effekt von Nährstoff-Synergie auf MMP-2 und MMP-9 durch Osteosarkomzellen
3. Invasions-Studie
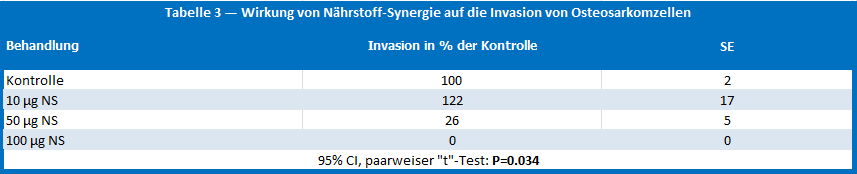
Figur 3 — Wirkung von Nährstoff-Synergie (NS) auf Matrigel-Invasion und Wanderung durch menschliche Osteosarkomzellen U-2 OS
A. Kontrolle
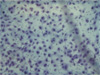
B. 10µg/ml NS
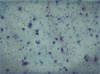
C. 50µg/ml NS
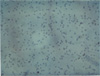
D. 100µg/ml NS
Figur 4 — Invasions-Studie: Hematoxylin & Eosin bebeiztes mikroskopisches Schliffbild
Diskussion
Die Ergebnisse dieser Studie zeigen bedeutende anti-proliferative Hemmung (60% Hemmung bei 1000 m g/ml) ohne morphologische Änderungen und drastische anti-invasive Effekte von Nährstoff-Synergie in vitro auf menschliche Osteosarkomzellarten U-2 OS. Die Matrigel-Invasion und die MMP-Expression von MMP-2 und MMP-9 durch Osteosarkomzellen nimmt in dosisabhängiger Art und Weise mit vollständiger Hemmung der Invasion und MMP-Expression bei 100 m g/ml bzw. 500 m g/ml ab.
Die Matrix-Invasion kann durch die Hemmung der MMP-Expression eingeschränkt werden wie auch durch die Stärke und Stabilität des wachsendes Bindegewebes, die zur „Einkapselung“ des Tumors beitragen. In dieser Studie stimmte der dosisabhängige Hemmungseffekt von Nährstoff-Synergie auf die Expression von MMP-9 und MMP-2 von Osteosarkomzellen überein mit der dosisabhängigen Hemmung der Matrix-Invasion. Außerdem war die Matrix-Invasion wahrscheinlich auch beeinflusst durch die größere Stabilität und Stärke des Bindegewebes, das die Aktivität des Nährstoffs der Nährstoff-Synergie unterstützte. Die Optimierung der Synthese und Struktur der Bindegewebsfibrille hängt ab von der Hydroxylation der Rückstände von L-Hydroxyprolin und Hydroxylysin in den Kollagenfasern. Es ist gut bekannt, dass Askorbinsäure für die Hydroxylation dieser Aminosäuren wesentlich ist. Askorbinsäure und Lysin werden im menschlichen Körper nicht produziert, deshalb können unzureichende Grade dieser Nährstoffe in verschiedenen pathologischen Stadien vorkommen wie auch durch mangelhafte Diäten. Obwohl Prolin aus Arginin synthetisch hergestellt werden kann, mag seine Synthese und/oder Hydroxylation in ihren pathologischen Eigenschaften unzureichend sein.
Über die Hemmungseffekte der einzelnen Nährstoffe in Nährstoff-Synergie ist berichtet worden, sie bewiesen ihre hemmenden Effekte in klinischen und in experimentellen Studien. Askorbinsäure ist bekannt für seine zytotoxischen und antimetastatischen Eigenschaften auf maligne Zellsorten (5)(6)(7); außerdem wurde von niedrigen Askorbinsäureständen bei Krebspatienten berichtet (8)(9)(10). ECGC ist ein starker Antikrebs-Wirkstoff, von dem berichtet wird, dass es einen wachstumshemmenden Effekt gegen bestimmte menschlicht Krebszellarten hat (11)(12)(13).
Die einzelnen Nährstoffe sind jedoch nicht so effektiv wie Nährstoff-Synergie. Unsere früheren Studien zeigten, dass der synergetische Antikrebseffekt von Askorbinsäure, Prolin, Lysin und EGCG auf verschieden Krebszellarten in Gewebekulturstudien größer war als der von einzelnen Nährstoffen (14). Während die Chemotherapie wahllos Schäden an Zellen und ECM verursacht, haben unsere morphologischen Studien gezeigt, dass auch die höchsten Konzentrationen von Nährstoff-Synergie die Osteosarkomzellen nicht angreifen. Das zeigt, dass diese Rezeptur für Zellen unschädlich ist.
Folgerungen
Unsere Ergebnisse zeigen, dass Nährstoff-Synergie wegen seiner Hemmung der Zellproliferation, MMP-Expression, und Invasion ein ausgezeichneter Kandidat für den therapeutischen Gebrauch bei der Behandlung von hochaggressiven Osteosarkomen ist.
Referenzen
- Miller R, Dowshen S, and Trigg M, Childhood Cancer: Osteosarcoma (May 2002) The Nemours Foundation: Kids Health
- Jaffe N, Carrasco H, Raymond K, Ayala A, Eftekhari F (2002). Can cure in patients with osteosarcoma be achieved exclusively with chemotherapy and abrogation of surgery? Cancer . 10 , 2202-10.
- Rath M and Pauling L (1992). Plasmin-induced proteolysis and the role of apoprotein(a), lysine and synthetic analogs. Orthomolecular Medicine . 7 ,17-23)
- Netke SP, Roomi MW, Ivanov V, Niedzwiecki A, and Rath M (2003). A specific combination of ascorbic acid, lysine, proline and epigallocatechin gallate inhibits proliferation and extracellular matrix invasion of various human cancer cell lines. Research Communications in Pharmacology and Toxicology
- Koh WS, Lee SJ, Lee H, Park C, Park MH, Kim WS Yoon SS, Park K, Hong SI, Chung MH, Park CH. (1998). Differential effects and transport kinetics of ascorbate derivatives in leukemic cell lines. Anticancer Res 8 , 2487-2493.
- Roomi MW, House D, Eckert-Maksic M, Maksic ZB, Tsao CS(1998). Growth suppression of malignant leukemia cell line in vitro by ascorbic acid (vitamin C) and its derivatives. Cancer Letters 122 , 93-99.
- Naidu KA, Karl RC, Naidu KA, Coppola D (2003). Antiproliferative and proapoptotic effect of ascorbyl stearate in human pancreatic cancer cells: association with decreased expression of insulin-like growth factor 1 receptor. Dig Dis Sci 48 (1), 230-7.
- Anthony HM, Schorah CJ (1982). Severe hypovitaminosis C in lung-cancer patients: The utilization of vitamin C in surgical repair and lymphocyte related host resistance. Br J Cancer 46 , 354-367
- Nunez C, Ortiz de Apodaca Y, Ruiz A (1995). Ascorbic acid in the plasma and blood cells of women with breast cancer. The effect of consumption of food with an elevated content of this vitamin. Nutr Hosp . 10, 68-372.
- Kurbacher CM, Wagner U, Kolster B, Andreotti PE, Krebs D, Bruckner HW (1996). Ascorbic acid (vitamin C) improves the antineoplastic activity doxorubicin, cisplatin and paclitaxel in human breast carcinoma cells in vitro. Cancer Lett . 103 (2),183-189.
- Valcic S, Timmerman BN, Alberts DS, Wachter GA, Krutzch M, Wymer J, Guillen JM (1996). Inhibitory effects of six green tea catechins and caffeine on the growth of four selected human tumor cell lines. Anticancer Drugs . 7, 461-468.
- Mukhtar H and Ahmed N (2000). Tea polypheonols: prevention of cancer and optimizing health. Am J Clin Nutr . 71, 1698S-1720S.
- Yang GY, Liao J, Kim K, Yurkow EJ, Yang CS (1998). Inhibition of growth and induction of apoptosis in human cancer cell lines by tea polyphenols. Carcinogenesis. 19, 611-616.
- Netke SP, Roomi MW, Ivanov V, Niedzwieck A, and Rath M. A specific combination of ascorbic acid, lysine, proline and epigallocatechin gallate inhibits proliferation and extracellular matrix invasion of various human cancer cell lines.


