 Krebs ist die zweithäufigste Todesursache der Welt. Laut Prognosen der Internationalen Agentur für Krebsforschung, einer Einrichtung der Weltgesundheitsorganisation (WHO), könnte sich die Zahl der Krebskranken bis zum Jahre 2030 sogar um rund 75 bis 90 Prozent erhöhen – und das, obwohl Jahr für Jahr Unsummen für die Krebsforschung ausgegeben werden. Die Erklärung hierfür ist einfach: Die etablierten Krebsforschungseinrichtungen befassen sich im Wesentlichen mit den bekannten, herkömmlichen Ansätzen der Krebstherapie, verschließen sich aber meist neueren, innovativeren Konzepten.
Krebs ist die zweithäufigste Todesursache der Welt. Laut Prognosen der Internationalen Agentur für Krebsforschung, einer Einrichtung der Weltgesundheitsorganisation (WHO), könnte sich die Zahl der Krebskranken bis zum Jahre 2030 sogar um rund 75 bis 90 Prozent erhöhen – und das, obwohl Jahr für Jahr Unsummen für die Krebsforschung ausgegeben werden. Die Erklärung hierfür ist einfach: Die etablierten Krebsforschungseinrichtungen befassen sich im Wesentlichen mit den bekannten, herkömmlichen Ansätzen der Krebstherapie, verschließen sich aber meist neueren, innovativeren Konzepten.
Das Dr. Rath Forschungsinstitut hat bei der Erarbeitung neuer Erklärungs- und Behandlungsansätze im Bereich Krebs Pionierarbeit geleistet. Wichtiges Augenmerk liegt dabei auf der Bekämpfung der Krebsausbreitung (Metastasierung). Dies ist insbesondere deshalb so bedeutsam, weil Krebsmetastasen – und nicht der Primärtumor – für mehr als 90 % aller Krebstodesfälle verantwortlich sind.
Im Mittelpunkt unserer Forschung steht das Bindegewebe, dessen Stabilität und Unversehrtheit eine grundlegende Voraussetzung dafür ist, die Ausbreitung bösartiger Zellen im Körper zu unterbinden. Unser Ansatz beruht auf der Anwendung natürlicher, ungiftiger Substanzen zur Unterstützung und Optimierung des Bindegewebes und seiner Funktionen.
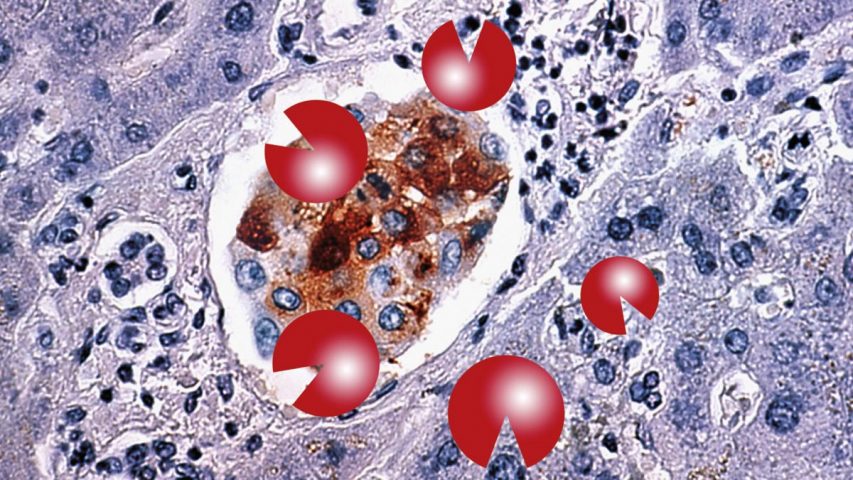
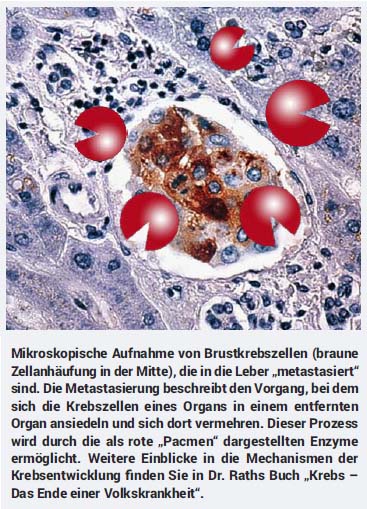
In zahlreichen Studien haben wir bestätigen können, dass eine synergistisch wirkende – also sich wechselseitig verstärkende – Kombination von Mikronährstoffen (Vitamin C, Lysin, Prolin, Grüntee-Extrakt und andere) die Ausbreitung von Krebszellen sowie weitere entscheidende Krebsmechanismen hemmen kann. Wichtige Funktionen dieser Mikronährstoff-Kombination sind die Stärkung des Bindegewebes und die Blockade bestimmter Enzyme, die von Krebszellen produziert werden, um das Bindegewebe aufzulösen und in andere Organe zu gelangen (siehe Bild unten). Die Wirksamkeit der o. g. Mikronährstoff-Kombination ist von uns an über 60 verschiedenen Krebszellarten nachgewiesen worden.
Kürzlich haben die Wissenschaftler des Dr. Rath Forschungsinstituts einen weiteren Beweis für die zentrale Rolle von gesundem Bindegewebe in der Krebsbekämpfung geliefert und damit ein Konzept bekräftigt, das vor mehr als 20 Jahren von Dr. Rath aufgestellt wurde.
Nach diesem Konzept führt langanhaltender Vitamin-C-Mangel zu einer Schwächung und Instabilität des Bindegewebes, die der Körper mithilfe eines einzigartigen Reparaturmoleküls namens Lipoprotein(a) [Lp(a)] zu überbrücken versucht, welches zum „Abdichten“ des Bindegewebes herangezogen wird. Diese Funktion von Lp(a) kommt auch bei Krebs zum Tragen: Als Bestandteil eines durch Vitamin-C-Mangel geschwächten Bindegewebes trägt Lp(a) dazu bei, Krebszellen an ihrer Ausbreitung im Körper zu hindern.
Zur Bestätigung dieses Konzepts haben wir Studien mit einem einzigartigen Maus-Modell durchgeführt, welches eigens an unserem Forschungsinstitut entwickelt wurde. Dieses Modell ahmt zwei wichtige Aspekte nach: 1. die Unfähigkeit, körpereigenes Vitamin C herzustellen; 2. stattdessen Lp(a)-Moleküle zu produzieren. Unser Maus-Modell stellt damit ein Ereignis der menschlichen Evolution nach, das vor über 40 Millionen Jahren in unseren Vorfahren stattgefunden hat.
Anhand dieses Modells konnten wir eindeutig nachweisen, dass Lp(a) vom Körper als Reparaturmolekül eingesetzt wird, um brüchige Blutgefäßwände instand zu setzen. In letzter Konsequenz führt dieser Reparaturprozess bei chronischem Vitamin-C-Mangel zu Atherosklerose, der Hauptursache für Herzinfarkt und Schlaganfall.1
Eine weitere Studie2 an diesem Maus-Modell befasste sich mit den natürlichen Mechanismen des Wachstums und der Entwicklung von Krebszellen. Dabei gingen wir insbesondere der Frage nach, ob Lp(a) bei Krebs eine ähnliche Funktion wahrnimmt wie bei der Herz-Kreislauf-Erkrankung, nämlich die eines Reparaturmoleküls bei Vitamin-C-Mangel. In der Tat stellten wir fest, dass Lp(a) ein wichtiger Stabilitätsfaktor für das Bindegewebe ist, der zu einer verminderten Entwicklung von Primärtumoren und Metastasen beiträgt.
Quelle:
- J. Cha, A. Niedzwiecki, M. Rath; Am J Cardiovasc Dis 2015;5(1):53-62
- J. Cha, MW Roomi, et. al, Int J Onco 49:895-902, 2016
Weitere Details hierzu erfahren Sie in der nächsten „Wahr“-Ausgabe.